◆このページでは、主に、動物用医薬品、獣医師に関係する事項について記載しています。
◆動物用医薬品販売業等については、「各種申請書等の様式」ページをご覧ください。法令の概要等も掲載しております。
※注意:内容については、簡略化した記述部分がありますので、必ず法令等の原文をご確認ください。
※関係法令等については、次のとおり記載しています。
○医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(旧・薬事法)→ 「法」
○医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行令 → 「令」
○動物用医薬品等取締規則 → 「取締規則」
○動物用医薬品及び医薬品の使用の規制に関する省令 → 「規制省令」
○医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律関係事務に係る技術的な助言について →「助言」
※法令についてはこちらを参照 → 医薬品医療機器等法並びに関係の政令、省令及び通知の改正/ 動物用医薬品等に関する法令・通知等一覧(リンク集)/ 動物用医薬品等に関する法令・通知等(農林水産省)
1.責務
◆国の責務
第1条の2 国は、この法律の目的を達成するため、必要な施策を策定し、及び実施しなければならない
◆都道府県の責務
第1条の3 都道府県、政令市、特別区は、国との適切な役割分担を踏まえて、施策を策定し、及び実施しなければならない
◆医薬品関連事業者の責務
第1条の4 医薬品の製造、販売、貸与、修理業者、飼育動物診療施設開設者は、医薬品等の品質、有効性及び安全性の確保並びにこれらの使用による保健衛生上の危害の発生及び拡大の防止に努めなければならない
◆医薬関係者の責務
第1条の5 獣医師その他の医薬関係者は、医薬品等の有効性、安全性、適正使用に関する知識と理解を深め、使用者、購入(譲渡)者に対し、これらの情報の提供に努めなければならない
◆国民の役割
第1条の6 国民は、医薬品等を適正に使用するとともに、これらの有効性及び安全性に関する知識と理解を深めるよう努めなければならない
2.医薬品とは
(法第2条)
◆医薬品とは
・日本薬局方に収められている物
・人又は動物の疾病の診断、治療又は予防に使用されることが目的とされている物であって、機械器具等でないもの
・人又は動物の身体の構造又は機能に影響を及ぼすことが目的とされている物であって、機械器具等でないもの
◆体外診断用医薬品とは
・専ら疾病の診断に使用されることが目的とされている医薬品のうち、人又は動物の身体に直接使用されることのないものをいう。
<注意>
※医薬品と記載されていなくても、製品の形状、製品のパッケージ・広告宣伝物等で医薬品の成分が含まれる旨の成分表示、上記の目的に使用できるような効能効果が表示されている等の物は、医薬品等に該当します。 → 動物用医薬品等に該当するか否かの考え方(農林水産省)
○医薬品は、その直接の容器又は直接の被包に、規定された事項が記載されていなければならりません。例外規定あり。(法第50条~52条)
○人の医療に用いられる医薬品及び人・動物兼用の医薬品は、厚生労働大臣が所管しています。(医療機器、再生医療等製品も同様)
○専ら動物に用いられる動物用医薬品は、第83条の読み替え規定により農林水産大臣が所管しています。人用医薬品を動物用と宣伝して販売してはいけません。
○動物用医薬品の直接の容器等には「動物用医薬品」の文字を記載(取締規則第171条第1項)
○獣医師は、医薬品と動物用医薬品の両方を扱うことができます。
<参考>
○医薬部外品とは(概要):次の目的のために使用される物 ・吐きけ、口臭、体臭防止 ・あせも、ただれ等防止 ・脱毛防止、育毛、除毛 ・ねずみ、はえ、蚊、のみ等の防除目的 など。人用医薬部外品についても動物用と宣伝して販売してはいけません。
○化粧品:動物用には規定がありません。
○処方箋により調剤された薬剤は解釈上医薬品には該当しないとされています(一般に流通しないため、出典:医薬品医療機器法逐条解説)。ただし、動物用については、助⾔の第9の1(3)において、使⽤規制省令第2条第1号により規制の対象とする動物⽤医薬品及び同令第6条第1号により規制の対象とする医薬品には、獣医師が⾃ら調剤したもの⼜は獣医師の処⽅せんによって調剤したものを含むものと解釈されています。
3.医療機器とは
(法第2条)
◆「医療機器」とは、人若しくは動物の疾病の診断、治療若しくは予防に使用されること又は身体の構造若しくは機能に影響を及ぼすことが目的とされている機械器具等であつて、政令で定めるものをいいます。
◆「高度管理医療機器」とは、副作用又は機能の障害が生じた場合、動物の生命及び健康に重大な影響を与えるおそれがあるもの
◆「管理医療機器」とは、副作用又は機能の障害が生じた場合、動物の生命及び健康に影響を与えるおそれがあるもの
◆「一般医療機器」とは、副作用又は機能の障害が生じた場合、動物の生命及び健康に影響を与えるおそれがほとんどないもの
◆「特定保守管理医療機器」とは、保守点検、修理その他の管理に専門的な知識及び技能を必要とするもの : 動物用には該当する機器は無い(2024年現在)
○動物用医療機器の区分、一般名称等
○動物用医療機器の種類:令別表第1
○中古の医療機器であっても、当該法令の対象です。
○医療機器の修理は、修理業の許可を受けた者以外はできません(法第40条の2、第40条の3)。
4.再生医療等製品とは
◆「再生医療等製品」とは、次に掲げる物(医薬部外品及び化粧品を除く。)であつて、政令で定めるものをいいます。(法第2条)
○次に掲げる医療又は獣医療に使用されることが目的とされている物のうち、人又は動物の細胞に培養その他の加工を施したもの
・ 人又は動物の身体の構造又は機能の再建、修復又は形成
・ 人又は動物の疾病の治療又は予防
○人又は動物の疾病の治療に使用されることが目的とされている物のうち、人又は動物の細胞に導入され、これらの体内で発現する遺伝子を含有させたもの
○動物用再生医療等製品の種類:令別表第2
◆以下、動物用の「医薬品」「再生医療等製品」「医療機器」を併せて、「医薬品等」と記述しています。
5.生物由来製品とは
(法第2条)
◆「生物由来製品」とは、人その他の生物(植物を除く。)に由来するものを原料又は材料として製造をされる医薬品、医薬部外品、化粧品又は医療機器のうち、保健衛生上特別の注意を要するものとして、厚生労働大臣が薬事・食品衛生審議会の意見を聴いて指定するものをいう。
◆「特定生物由来製品」とは、生物由来製品のうち、販売し、貸与し、又は授与した後において当該生物由来製品による保健衛生上の危害の発生又は拡大を防止するための措置を講ずることが必要なものであつて、厚生労働大臣が薬事・食品衛生審議会の意見を聴いて指定するものをいう。
○人や動物の血液・臓器等、病原微生物を原材料とする医薬品等(ワクチンなど)は、適正に製造された製品であっても、重大な結果を引き起こす可能性があることから、厳格な規定が設けられています。
○再生医療等製品は含まれていませんが、再生医療等製品には生物由来製品と同等以上の厳格な規定が設けられています。
6.動物用医薬品等の流通と管理の概要
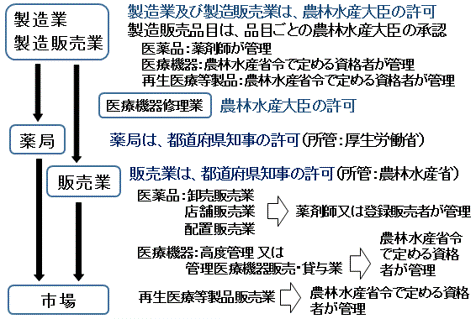
7.読み替え規定(主なもの)
◆人用の法律を適用しているため、動物用に対応する条文となるように、次のとおり読み替えを行っています。
◆法第83条
・「厚生労働大臣」→「農林水産大臣」
・「厚生労働省令」→「農林水産省令」
・「人」→「動物」
・「医療を受ける者」→「獣医療を受ける動物の飼育者」
・「国民の生命及び健康」→「動物の生産又は健康の維持」
・「医師等の処方箋」→「獣医師等の処方箋・指示」
・「第一類医薬品、第二類医薬品又は第三類医薬品」→「指定医薬品又はそれ以外の医薬品」
・第14条第2項第3号ロ中「認められるとき」→「認められるとき、又は申請に係る医薬品が、その申請に係る使用方法に従い使用される場合に、当該医薬品が有する対象動物(牛、豚その他の食用に供される動物として農林水産省令で定めるものをいう。以下同じ。)についての残留性の程度からみて、その使用に係る対象動物の肉、乳その他の食用に供される生産物で人の健康を損なうものが生産されるおそれがあることにより、医薬品として使用価値がないと認められるとき」
8.医薬品販売業等の許可
◆薬局開設者又は販売業等の許可を受けた者以外は、販売、授与又はそれらの目的で貯蔵、陳列してはならない。(法第24条)
◆高度管理医療機器又は特定保守管理医療機器の販売業等の許可を受けた者以外は、販売、授与、貸与又はそれらの目的で陳列又は高度管理医療機器プログラムの提供等してはならない。(法第39条)
管理医療機器については、都道府県知事に届け出なければならない。(法第39条の3)
◆再生医療等製品の販売業の許可を受けた者以外は、販売、授与又はそれらの目的で貯蔵、陳列してはならない。(法第40条の5)
◆販売業等に関する法令の概要(動物用)
店舗販売業 / 特例店舗販売業 / 卸売販売業 / 再生医療等製品販売業 / 高度管理医療機器等販売・貸与業 / 管理医療機器販売・貸与業 / 販売業等の種類と概要
リンクが切れている場合は⇒「各種申請書等の様式」をご覧ください。
○飼育動物診療施設(動物病院)内で医薬品等を保管することは問題ありません。
○獣医師が診察をした動物について、医薬品等を処方することは、販売等には当たりません。
しかし、診察をせずに(カルテに記載せずに)医薬品を処方すると、販売・譲渡にあたり、無許可販売で法に抵触します。
○インターネット等での販売も販売業の許可が必要です。
○未承認医薬品等、使用期限切れ医薬品等の販売、貯蔵、陳列、広告等は禁止されています(法第56~57条、60条、法第66~68条、取締規則第104条の4)。
※下記「9.動物用医薬品等の製造及び輸入」「14.未承認医薬品等」「20.動物用医薬品の広告について」「(参考)動物用医薬品等に該当するか否かの考え方」も参照
○医薬品を競売(オークション)にかけることは禁止されています(取締規則第104条の5)。
○医薬部外品、化粧品の販売・譲渡・貯蔵・陳列については、許可は必要ありません。
○高度管理医療機器・管理医療機器・特定保守管理医療機器は、中古品であっても、販売・授与・貸与・陳列・提供は許可や届出が必要です。
○一般医療機器(特定保守管理医療機器を除く)については、販売・授与・貸与・陳列・提供の許可や届出は不要ですが、品質の確保等の遵守義務が定められています(法第9条第1項、第40条第3項、取締規則第122~128条、第132条第2項、第134条第2項)。
9.動物用医薬品等の製造及び輸入
◆動物用医薬品等の製造・輸入は、該当する許可等を受けた者以外は原則禁止されています(法第83条他)。なお、販売等に許可等の必要がない医薬部外品・化粧品・一般医療機器も、製造・輸入する場合は、原則該当する許可等が必要です。(注意)人用医薬品は、「業として」製造してはならないことになっていますが、動物用医薬品は業と見なされない製造であっても規制対象です。(出典:医薬品医療機器法逐条解説)
◆獣医師又は飼育動物診療施設の開設者は、動物の疾病の診断、治療又は予防の目的で使用するために動物用医薬品等(体外診断用医薬品でない生物学的製剤は除く)の製造又は輸入をすることが、例外的に認められています(ただし、問題が起きれば獣医師の責任が問われます。)(法第83条の2、第83条の2の2、取締規則第213条、第214条)。その他の例外事項については取締規則第213条等参照。輸入した動物用医薬品等については、使用・受払に関する記録を作成し、「動物用医薬品等輸入確認願」を提出した日から3年間保存してください。
◆「個人輸入」に関しては、農林水産省のホームページ をご覧ください。なお、医薬品的な成分を含んだり、医薬品的な効能効果の表示(外国語表示も含む)があったりするペットフード、家畜用飼料、シャンプー等は、動物用医薬品等に該当します。このような製品を輸入する場合も、申請手続が必要となります。個人輸入された動物用医薬品等を日本国内で販売・譲渡することは禁止されています(未承認医薬品等販売に該当)。
なお、輸入仲介サイトには違法な業者もあり、輸入時のトラブル、偽薬・違法医薬品販売、不良薬品使用による副作用や健康被害等の可能性もあるため、購入前に農林水産省ホームページをご一読ください。
◆「販売・譲渡等」の目的で製造・輸入する場合は、該当する許可等が必要です。手続き方法等は 農林水産省のホームページ をご覧ください。 主なもの:動物用医薬品等の製造販売業許可申請(販売目的で製造や輸入をする、事業者としての手続き)、動物用医薬品等の製造販売承認申請(販売目的で輸入する、品目としての手続き)、動物用医薬品等の外国製造業者認定(仕入先となる外国製造業者に取得が必要な手続き)、動物用医薬品等の製造業許可申請等(製造、輸入後の包装・表示・保管等を行うための、事業者としての手続き)
◆人用や人・動物兼用の医薬品等を製造・輸入する場合は、厚生局(厚生労働省) にお問い合わせください。
<参考>
○「製造販売」とは、その製造(他に委託して製造をする場合を含み、他から委託を受けて製造をする場合を除く。以下「製造等」という。)をし、又は輸入をした医薬品(原薬たる医薬品を除く。)、医薬部外品、化粧品、医療機器若しくは再生医療等製品を、それぞれ販売し、貸与し、若しくは授与し、又は医療機器プログラム(医療機器のうちプログラムであるものをいう。以下同じ。)を電気通信回線を通じて提供することをいう。(法第2条)
○医薬品等の元売りを行う者(製造販売業者)が、その品質、有効性、安全性の全てに責任を負うものとされています。(出典:医薬品医療機器法逐条解説)
10.医薬品の取り扱い
◆医薬品の中で、取り扱いに注意を要するものについては、様々な規定が設けられています。主な区分は次のとおりです。
○毒薬、劇薬
○要指示医薬品
○医薬品の使用規制と使用禁止
○麻薬、向精神薬
○指定医薬品
11.毒薬、劇薬の取り扱い
◆毒薬・劇薬は、
・急性毒性が強いもの
・慢性毒性が強いもの
・薬効が期待される摂取量(薬用量)と中毒のおそれがある摂取量(中毒量)が接近しており安全域が狭いもの
であり、取り扱いに特に注意が必要なものとして、販売・譲渡・交付・貯蔵・陳列について制限等の規定が設けられています。
◆毒薬・劇薬の種類:取締規則第163条、別表第2、第3
(別表第2は、毒性等強いもので動物専用医薬品、厚生労働大臣の所管外)
◆ 表示(法第44条) : 次のような「毒」「劇」の表示をしなければなりません。
◆ 開封販売の制限(法第45条) : 薬剤師のいない販売業者は、開封してはいけません。
◆ 譲渡手続き(法第46条) : 販売(譲渡)する場合は、譲受人から厚生労働省様式文書の提出を受けなければなりません(薬剤師・獣医師等の資格証明書を確認した場合はこの限りではない)。この文書は2年間保存しなければなりません。
◆ 交付の制限(法第47条) : 14歳未満の者その他安全な取扱いをすることについて不安があると認められる者には、交付してはなりません。
◆ 貯蔵及び陳列(第48条) : 業務上毒薬又は劇薬を取り扱う者は、これを他の物と区別して、貯蔵、陳列しなければなりません。毒薬を貯蔵、陳列する場所には、鍵を施さなければなりません。
<参考>毒物・劇物について
○医薬品ではない「毒物・劇物」については、「毒物及び劇物取締法」に従ってください。
○製造、輸入、販売、購入手続き、保管等について、規定が設けられています。
○概要はこちら ⇒ 一般社団法人日本試薬協会HP
12.要指示医薬品の取扱い
◆要指示医薬品(人では「処方箋医薬品」)とは、
・使用に当たって、獣医師等の専門的な知識と技術を必要とするもの
・副作用の強いもの
・病原菌に対して耐性を生じやすいもの
として、販売業者は、獣医師等から処方箋(指示書)の交付を受けた者以外には、販売、授与してはならない医薬品。(法第49条)
(ただし、薬剤師・獣医師・医薬品販売業者等への販売等は可(取締規則第104条の3)。こちらも参照)
◆販売(授与)にあたっては、あらかじめ、指示等を受けたか否かを確認しなければなりません(規則第104条の3)
◆要指示医薬品の種類
○農林水産大臣の指定する医薬品は、取締規則「別表第3」に掲げられているもの。(取締規則第168条)
○抗菌性物質、生物学的製剤のうちワクチン(鶏痘ワクチンを除く)、ホルモン剤などが指定されています
◆直接の容器等に、「注意―獣医師等の処方箋・指示書により使用すること」 と記載されていなければなりません。
◆販売(授与)した場合は、帳簿を備え、2年間保存しなければなりません。(法第49条)
◆獣医師が指示書を交付する場合の留意事項:「獣医師自ら診察する」「指示書の記載方法」など → 詳細はこちら
◆使用者への指導事項(助言)
○要指示医薬品は、副作用が強いもの、あるいは病原菌に対して耐性を生じやすいもの等、その使用期問中獣医師の特別の指導を必要とするものが指定されているので、使用者に対しては機会あるごとに指定の趣旨を徹底し、獣医師によリ指示された用法及び用量、休薬期間、使用上の注意等に従って使用するよう指導し、事故防止に万全を期すようお願いします。
◆処方箋と指示書
○「処方箋」は、医師等(歯科医師・獣医師)が治療上薬剤を調剤して投与する必要があると認めた場合に患者等に対して交付する物である(医師法第22条等)。薬剤師は、医師、歯科医師又は獣医師の処方せんによらなければ、販売又は授与の目的で調剤してはならない(薬剤師法第23条)。薬剤師は処方内容の確認・調剤を行い、服薬方法や注意点などを説明のうえ販売・授与する。
○「指示書」は、獣医師が、動物用医薬品販売業者からの要指示医薬品購入や使用について、畜主に指示する文書。
13.医薬品等の使用規制
◆人の健康に悪影響を及ぼす可能性がある医薬品が、畜産物へ残留しないよう、対象動物への使用が制限されています。
1「未承認医薬品」:対象動物への使用が禁止されている医薬品
2「使用規制対象医薬品」:対象動物への使用方法が規定されている医薬品
3「使用禁止医薬品」:食用動物への使用が禁止されている医薬品
4「獣医師の使用の特例」:上記の医薬品を獣医師が使用するときは、やむを得ない場合であれば、例外的な使用も可能 (ただし、食用動物への使用が全面的に禁止されているものがあります)
◆食用動物 と 対象動物
・食用動物とは:食用に供する対象動物、生産物を食用とする対象動物
・対象動物とは:牛、馬、豚、鶏、うずら、みつばち、食用に供するために養殖されている水産動物
14.未承認医薬品等
◆未承認医薬品等(※1)を対象動物に使用してはなりません。ただし、試験研究目的など農林水産省令で定める場合(※2)は例外が認められています。(法第83条の3)
※1 直接の容器若しくは直接の被包に法第50条に規定する事項が記載されている医薬品以外の医薬品、法第65条の2に規定する事項が記載されている再生医療等製品以外の再生医療等製品
※2 試験研究、獣医師の例外的な使用(特例使用)、家畜防疫員が家畜伝染病予防法に基づき使用する場合 など (医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律に基づく医薬品及び再生医療等製品の使用の禁止に関する規定の適用を受けない場合を定める省令 、 妥当な臨床研究の範囲:臨床研究において使用される未承認動物用医薬品等の提供等に係る医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律の適用について(令和5年4月20日 5消安第440号)
15.使用規制対象医薬品
◆動物用医薬品等及びその他の医薬品等(人用医薬品など)のうち、適正に使用されなければ乳肉等に残留し、人の健康を損なうおそれのあるものについては、使用者が遵守すべき基準が定められています(法第83条の4、5)。
○使用規制対象医薬品は、別表第1及び第2に掲げられた方法で使用しなくてはなりません(対象動物、用法・用量、使用禁止期間(出荷制限期間)を規定)
○人用医薬品を対象動物に使用する場合も、動物用医薬品と同様の基準が適用されます。
◆人用医薬品等であっても、対象動物に使用する場合には、動物用医薬品の使用規制に関する規定が適用されます(法第83条の5)。
◆医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律関係事務に係る技術的な助言について
○使用規制対象医薬品を使用した場合は、使用者は、帳簿に必要事項を記載するよう努めなければならない (「使用規制省令第4条」「助言第9」:下記「17.動物用医薬品の使用に係る帳簿への記載」参照)
○獣医師が使用した場合は、所有者等に、使用禁止期間(出荷制限期間)を確実に(なるべく文書で)伝えなければならない。
○獣医師が使用した場合は、診療簿に記載しなければならない(「獣医師法施行規則第11条」:診療年月日、診療動物の種類・性・年齢(不明のときは推定年齢)・名号・頭羽数・特徴、診療動物の所有者又は管理者の氏名又は名称及び住所、病名及び主要症状、りん告、治療方法(処方及び処置) 「助言第9」:使用禁止期間(出荷制限期間))
◆抗菌性物質は、薬剤耐性菌対策として、慎重使用(必要最小限の使用等)が求められています。⇒ 下記(参考)動物用抗菌性物質の慎重な使用について 参照
◆使用禁止期間(出荷制限期間) と 休薬期間
○使用禁止期間
・「動物用医薬品の使用の規制に関する省令」で、使用基準として定められたもので、医薬品の使用が禁止される期間(医薬品使用後に食用としての出荷が制限される期間)。違反すると罰則があります。
○休薬期間
・医薬品の承認事項で、法による遵守義務はありません。
・休薬期間を守らないと生産物中に残留する恐れがあります。万が一、食品中に規定量以上の薬剤成分が残留した場合は、食品衛生法違反で回収命令等となる可能性があります。下記(参考)動物用医薬品等の畜水産食品中への残留基準、飼料の安全性対策 を参照。
16.使用禁止医薬品
◆人の健康に悪影響を及ぼす可能性がある特定成分を有効成分とする未承認医薬品、動物用医薬品及び人用医薬品を食用動物に使用することは禁止されています。(法第83条の3,4,5)
◆医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律に基づく医薬品の使用の禁止に関する規定の適用を受けない場合を定める省令
○未承認医薬品のうち、次の成分を有効成分とするものは、獣医師の特例使用の対象から除外(特例使用はできません)。(別表)
ニフルスチレン酸ナトリウム、ニタルソン、ロキサルソン(R5.9追加)、ゲンチアナバイオレット(R3.12追加)、イプロダニゾール(H29.8追加)、クロルスロン(H28.3追加)、オラキンドックス(H27.8追加)、カルバドックス、クマホス、クロラムフェニコール、クロルプロマジン、ジエチルスチルベストロール、ジメトリダゾール、ニトロフラゾン、ニトロフラントイン、フラゾリドン、フラルタドン、マラカイトグリーン、メトロニダゾール、ロニダゾール(これらは遺伝毒性や発がん性等の懸念から、食品衛生法により「食品から検出されてはならない」とされています)
◆動物用医薬品及び医薬品の使用の規制に関する省令
○動物用医薬品のうち、犬猫用及び観賞魚用として承認されている次の成分を有効成分とするものについて、食用動物への使用を禁止(別表第3)。
ニフルスチレン酸ナトリウム(R5.9追加)、クロラムフェニコール、ニトロフラゾン、マラカイトグリーン
※ 市販されている、これらを成分とする動物用医薬品につては、食用動物には使用できませんので、誤って投与しないよう注意!
○動物用医薬品以外の医薬品のうち、以下の成分を有効成分とするものについて、食用動物への使用を禁止(別表第4)。
クロラムフェニコール、クロルプロマジン、メトロニダゾール
○所有者又は管理者に対して「出荷禁止指示書(別記様式第1号)」により当該畜及び生産物を無期限で食用出荷してはならない旨を指示すれば、獣医師が別表第3、第4の医薬品を食用動物に使用することも可能ですが、安易に使用してはなりません。
使用した場合は、所有者又は管理者に対し、適切な標識等の識別方法により当該動物用医薬品又は医薬品を使用した個体、群を特定することが可能となるよう必要な措置を講じるよう指導すること。また、診療簿(カルテ)に必要事項を記載すること。
17.動物用医薬品等の獣医師による例外的な使用(特例使用)
◆獣医師が診療する対象動物の疾病の治療又は予防のため、やむを得ないと判断した場合に限り、上記「未承認医薬品」「使用規制対象医薬品」「使用禁止医薬品」の例外的な使用が認められています(法第83条の3,4,5)。ただし、問題が生じた場合は、獣医師の責任が問われます。
◆医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律に基づく医薬品及び再生医療等製品の使用の禁止に関する規定の適用を受けない場合を定める省令(法第83条の3関係)
○未承認医薬品等については、試験研究、獣医師の診療、家畜防疫員が家畜伝染病予防法に基づき使用する場合などで、対象動物に対する例外的使用が認められています。(ただし、試験研究以外では、別表に掲げる物質を有効成分とするものを使用することはできません→上記「使用禁止医薬品」参照)
◆動物用医薬品及び医薬品の使用の規制に関する省令 (法第83条の4,5関係)
○別表第1及び別表第2の動物用医薬品の欄に掲げる動物用医薬品について、使用基準を逸脱して使用する場合は、使用対象動物の種類に応じ、これらの表の使用禁止期間の欄に掲げる期間以上の期間(※1)を出荷制限期間(※2)として「出荷制限期間指示書(別記様式第2号)」により指示しなければなりません。
○別表第3、第4の医薬品を食用動物に使用した獣医師は、「出荷禁止指示書(別記様式第1号)」により当該畜及び生産物を無期限で食用出荷してはならない旨を指示しなければなりません。
○「出荷制限期間指示書」「出荷禁止指示書」に記載すべき事項について、電磁的方法により提供することが可能ですが、所有者又は管理者の承諾を受けたうえで行わなければなりません。
※1 対象動物及び生産物等に当該医薬品の残留がなくなり、人の健康を損なうおそれのある生産物が生産されなくなるまでの期間
※2 対象動物及びその生産物等を食用に供するために出荷してはならない期間
18.動物用医薬品の使用に係る帳簿への記載
◆動物用医薬品の使用者は、別表第1から別表第4までの動物用医薬品を対象動物に使用したときは、帳簿に記載するよう努めなければなりません。(動物用医薬品及び医薬品の使用の規制に関する省令)
1 当該動物用医薬品の名称
2 当該動物用医薬品の用法及び用量
3 当該動物用医薬品を使用した年月日
4 当該動物用医薬品を使用した場所
5 当該動物用医薬品使用対象動物の種類、頭羽尾数及び特徴
6 別表第1又は第2の動物用医薬品を使用した場合は、使用対象動物及び生産物を出荷等できる年月日
7 別表第3及び第4の動物用医薬品を使用した場合は、使用対象動物及び生産物を出荷等してはならないこと
19.指定医薬品とは
◆動物用医薬品は、「指定医薬品」 と 「指定医薬品以外の医薬品」 に区分されています。
◆指定医薬品とは(法第83条)
・薬理作用が非常に激しく使用方法の難しいもの
・その医薬品の有する化学的薬理的性質を十分に知らなければ危険性の大きいもの
・複雑な薬理作用を有するもの
であり、薬剤師でなければ取り扱えない医薬品として農林水産大臣が指定しています。
したがって、薬剤師がいない動物用医薬品販売業者では取り扱いができません。
◆医薬品の種類:取締規則第115条の2、別表第1
(毒薬・劇薬、抗菌性物質、ホルモン剤など)
◆「指定薬品」と「指定医薬品以外の医薬品」は区別して陳列しなければなりません(法第57条の2)。また、陳列方法に関する規定も設けられています。(取締規則第100条、助言第2の3)
<参考>
「人体用医薬品の区分」 薬局医薬品(処方箋医薬品等)、要指導医薬品、一般用医薬品(第1類、第2類、第3類)
「動物用医薬品の区分」 指定医薬品、指定医薬品以外の医薬品
20.動物用医薬品の広告について
◆医薬品、医薬部外品、化粧品、医療機器、再生医療等製品の名称、製造方法、効能、効果、性能について、明示的・暗示的を問わず、虚偽・誇大な記事、医師その他の者がこれを保証したものと誤解されるおそれがある記事を広告、記述、流布してはなりません。(法第66~68条)
○動物用医薬品等の広告について → 助言 第7-5,6参照
○「未承認動物用医療機器の展示に関するガイドライン」「動物用医薬品等広告適正化基準」/ 東京都HP 参照
(参考)動物用医薬品等に該当するか否かの考え方
◆「パッケージ、広告宣伝物等で、医薬品の成分が含まれる旨の成分表示のある物」、「疾病の診断・治療又は予防に使用されることが目的の物」、「身体の構造又は機能に影響を及ぼすことが目的とされている物」などは、医薬品等に該当します。
ペットフード、サプリメント、家畜用飼料、シャンプー、器具類等の動物用製品であっても、その物の成分、形状(剤型、容器、包装、意匠等)及びその物に表示された使用目的・効能効果・用法用量、販売方法、販売等の際の演述・宣伝などによっては、医薬品等に該当するものと判断される可能性があります。
◆詳細はこちらをご覧ください
〇 動物⽤医薬品等の範囲に関する基準について(農林水産省)
〇 無承認無許可医薬品の指導取締りについて(厚労省通知)
〇 無承認無許可医薬品の監視指導について(厚労省通知)
〇 専ら医薬品として使⽤される成分本質(原材料)リストを含むページ (厚労省HP)
〇 化粧品基準等(厚労省HP)
〇 ⽇本化粧品⼯業会HP(化粧品の成分表⽰名称リスト)
○ Cosmetic-Info.jp(化粧品表⽰名称)
〇 ペットフード等における医薬品的な表⽰について(農林水産省HP)
〇 家畜⽤飼料における医薬品的な表⽰について(農林水産省HP)
〇 ペットフード公正取引協議会ガイドライン
・ペットフード等の薬事に関する適切な表記のガイドライン
・ペットフード等の薬事に関する適切な表記の事例集
〇 ⼀般社団法⼈⽇本ペット⽤品⼯業会ガイドライン
・ペット⽤デンタル⽤品等の薬事に関する適切な表記のガイドライン
・ペット⽤シャンプー等の薬事に関する適切な表記のガイドライン
〇 体外診断⽤医薬品の取扱いについて(厚労省)
〇 プログラムの医療機器該当性に関するガイドライン等(厚労省)
○ 東京都HP
(参考)麻薬、向精神薬の取り扱い
◆麻薬
○平成18年にケタミンが麻薬に指定されました。(麻薬、麻薬原料植物、精神薬及び麻薬向精神薬原料を指定する政令(平成18年政令第50号))
○輸入、輸出、製造、譲渡、譲受、所持、施用等について規制されています。
○診療施設でケタミン等の麻薬を取り扱う場合には「麻薬施用者」の免許が必要です。また、2人以上の麻薬施用者が診療に従事する麻薬診療施設にあっては、麻薬管理者を1人置かなければなりません。診療施設は「麻薬業務所」を兼ねることとなります。
○麻薬を廃棄する場合は、事前に(人間の)保健所への届出が必要です。保健所職員等の立会のもと、廃棄しなければなりません。
注意)飼育動物診療施設(動物病院)を廃止※・開設の場合は、(人間の)保健所へ届出や申請が必要となります。詳細は → こちら(東京都HP) ※診療施設の移転、建て替え、個人→法人・法人→個人の変更等の場合は、旧施設の廃止、新施設の開設の届出が必要です。診療施設(動物病院)の新規届出・変更・廃止等については → こちら
◆向精神薬
○中枢神経に作用して精神機能に影響を及ぼし、乱用のおそれ及び乱用された場合の有害性の程度が麻薬及び覚せい剤より低いもので、麻薬及び向精神薬取締法及び政令で定めるものをいいます。
○譲渡(販売)、保管・管理、廃棄、事故の届出、記録などについて規定が設けられています。
○保管については、(1)病院・診療所・飼育動物診療施設の施設内に保管 (2)保管場所は、医療従事者が盗難の防止に必要な注意をしている場合以外は、鍵をかけた設備内で行うこと。 と定められています。
○向精神薬を廃棄するときは、焼却、酸・アルカリ等による分解、希釈、他の薬剤との混合等、回収が困難な方法により行って下さい(届出は必要ありません)(麻薬及び向精神薬取締法第50条の21、規則第40条)。
○第一種及び第二種向精神薬の、譲渡(販売)、譲受(購入)、廃棄については、必要事項を記録し、2年間保存して下さい。(麻薬及び向精神薬取締法第50条の23、規則第42条)
◆詳細はこちらをご覧ください。
麻薬・向精神薬について(北海道) / 麻薬を取り扱う獣医師の方へ(北海道) / 麻薬免許関係(札幌市HP) / 病院・診療所・飼育動物診療施設における向精神薬取扱いの手引き(大阪府のHP) / 向精神薬取扱いの手引(東京都HP)
<参考> 覚醒剤取締法 、麻薬及び向精神薬取締法 、麻薬及び向精神薬取締法施行規則 、ケタミンの取り扱い(質疑応答) 、動物捕獲等を目的としたケタミン使用者に係る取扱について
(参考)動物用抗菌性物質の慎重な使用について
◆動物用フルオロキノロン系等製剤の慎重な使用について
フルオロキノロン系合成抗菌剤及び第3世代以降のセファロスポリン系の抗生物質等(以下「フルオロキノロン系等製剤」)は、人の医療分野でも重要な医薬品であるため、フルオロキノロン系等製剤に対する薬剤耐性菌の出現防止に努めなければなりません。(助言)
○原則として感受性を確認し、適応症の治療上必要な最小限の期間の投与にとどめる。
○ 第一次選択薬が無効の症例に限り使用する。
○ 定められた用法用量を厳守する。
○用法に定められた期間以内の投与であっても、それを反復する投与は避ける。
○人用フルオロキノロン系等製剤の動物への使用、対象動物とされていない動物への使用等の適用外使用を避ける。
◆その他の抗菌性物質についても、薬剤耐性菌対策として、慎重な使用(必要最小限の使用)が求められています。これは、産業動物だけではなく、愛玩動物等にも当てはまります。
薬剤耐性菌は、抗菌性物質の使い過ぎなどにより増加します。増加した薬剤耐性菌が、家畜等の治療を困難にするだけでなく、畜産物等を介して、人の感染症の治療を困難にすることが懸念されています。
・飼養衛生管理水準の向上やワクチンの使用等により、感染症を予防しましょう。
・飼養者は、疾病の発生状況等の情報を獣医師に詳しく伝え、獣医師が適切な診断を出来るようにしましょう。
・抗菌性物質は獣医師からの指示に基づき、用法・用量、使用禁止期間等を守って正しく使用しましょう。
・獣医師は、抗菌性物質の使用を真に必要な場合に限定し、使用する場合は、感受性試験などにより、有効な抗菌性物質を選択し、必要最小限の使用としましょう。
・ フルオロキノロン等の第二次選択薬は第一次選択薬が無効の場合のみ使用しましょう。
(参考)動物用医薬品等の畜水産食品中への残留基準、飼料の安全性対策
◆厚生労働省は、食品中に残留する動物用医薬品等が人の健康に害を及ぼすことがないよう、人が摂取しても安全と評価した量(食品安全委員会)の範囲で食品ごとに設定されています。動物用医薬品等が基準値を超えて残留する食品の販売、輸入などは禁止されています。(食品衛生法第11条:ポジティブリスト制度)
○規制対象物質:農薬、動物用医薬品、飼料添加物
○規制対象食品:加工食品を含むすべての食品
○残留基準の区分
・対象外物質:厚生労働省で規定
・残留基準が設定されていない物質:一律基準(0.01ppm)を超えて残留してはならない
・残留基準が設定された物質:基準値を超えて残留してはならない
・検出されてはならない物質:遺伝毒性・発癌性物質、残留基準の設定されていない抗生物質(食品、添加物等の規格基準)
○ ポジティブリスト制度の詳細(厚生労働省)
○ 残留基準等(日本食品化学研究振興財団)
○食品中の残留農薬等の基準値データベース(厚生労働省)
○飼料添加物一覧(農林水産消費安全技術センター)
◆食品中に基準を超えた残留が認められた場合の措置
○違反者に食品の回収・出荷停止命令(食品衛生法)
○違反者の住所、氏名公表(食品衛生法)
○生産者へ立入調査(法)
◆飼料の安全性対策等
○飼料の安全関係 (農林水産省)
○家畜に使用する抗菌性物質について (農林水産省)
○飼料の安全性の確保及び品質の改善に関する法律 (飼料安全法)
○食品循環資源利用飼料(エコフィード)の安全確保について (農林水産省)
○わら 、飼料用の乾草の輸入について (動物検疫所)
○飼料の安全性に係るQ&Aなど (農林水産消費安全技術センター)
○飼料及び飼料添加物の製造、輸入、販売を行う事業者のみなさまへ (農林水産省)
◆ペットフードについて
○ペットフードの安全関係(農林水産省)
○愛がん動物用飼料の安全性の確保に関する法律(ペットフード安全法)(環境省)
●令和7年(2025年)の主な改正
◆「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律関係事務に係る技術的な助言について」の一部改正(令和7年4月25日)
◆動物用医薬品等取締規則の一部改正(令和7年4月25日農林水産省令第22号、同日施行)
○改正内容(PDF) / 官報号外第93号 :改正月日部分のみ
○主な改正事項
・責任役員の変更届出について、(責任役員)「の氏名」を追加(改姓等でも変更必要)。
・登録販売者を店舗等管理者にする場合の要件(業務経験等)の緩和。
・特例店舗販売業者の店舗における掲示事項に「取扱い品目の掲示」を義務化。
・管理医療機器営業所の届出事項変更届出で「責任役員の氏名」を追加。
・医薬品の直接の容器等の表示事項に係る例外事項の一部改正。
・体外診断⽤医薬品(⽣物学的製剤)における添付⽂書の表⽰事項の簡素化。
◆医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律(令和7年5月21日交付)
○動物用医薬品等関係については、農林水産省令の交付にあわせてお知らせします。
●令和6年(2024年)の主な改正、EUの薬剤規制強化
◆動物用医薬品等取締規則の一部改正:法第68条の2の5関係
○「第184条の13の2」を新設、令和6年12月1日施行
○医薬品等の包装等へのバーコード等の表示の義務付け
○表示箇所:容器又は被包 (容器・被包でなくても良い等の特例あり)
○対象:要指示医薬品、高度管理医療機器、再生医療等製品
○留意事項:印字だけは不可。バーコード等符号の表示必須。
GS1(人用の規定)でなくても良い → 「製造販売業者名、商品名:JANコード等の符号化」、「製造番号、使用期限:印字」、「添付文書の内容:二次元コード又は二次元コード付き紙文書」 など。 (二次元コードリンク先に製造販売業者名・商品名が記載されている場合は、二次元コードを、製造販売業者名・商品名の符号と考えても差し支えない)
◆EU等への輸出畜産物に係る動物用医薬品規制強化(R7年一部変更) ⇒ 詳細はこちら
●令和5年(2023年)の主な改正
◆「GQP省令(医薬品等)」「GMP省令(医療機器、体外診)」の一部改正(令和5年9月29日施行)
○第9条第5号第3号、10条第2号第2号、第10条第3号第1号、第11条第1号第5号 (GQP、GMP共通)
○製造販売業者による品質管理業務で、製造所の改善状況の確認が実地に限定されないように改正(「実地」の文言削除など)
◆デジタル原則を踏まえた当課所管法令の適用に係る解釈の明確化等について(令和5年9月29日 5消安第3774号 農林水産省消費・安全局畜水産安全管理課長)
◆医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律関係事務の取扱いについて(平成12年3月31日 12畜A第729号 農林水産省畜産局長)の一部改正新旧対照表
○自己点検等で定期的な検査が求められるものについて、デジタル技術の活用を踏まえ、実施期間や頻度の指定が必ずしも必要ない旨を明確化(実地監査、定期検査、点検)。
○監査等の際の資料の閲覧はオンライン上で行うことを基本とすることを明確化。
○実施すべき業務に支障が生じない範囲において、GMP省令上の製造管理責任者及び品質管理責任者の常駐・専任を求めている規定について、デジタル技術を活用した遠隔での職務実施や、複数施設での兼務常駐・専任を妨げるものでないことを明確化。 ※医薬品販売業等については変更なし(従来どおり)。
◆ 動物用医薬品等取締規則の一部改正(令和5年9月29日施行)
○第7条、第16条、第19条の6、第91条の5、第91条の13、第91条の83、第91条の92、第98条、第116条の4、第140条、第150条の5
○製造販売業、製造業、販売業の許可証の掲示は、原則インターネット(ホームページ等)で掲示。
上記が困難な場合※は、従前どおり、店舗等の見やすい場所に掲示する。
※困難な場合:ホームページ等が無い場合、一般客が来店する店舗 など
○インターネット掲示を行う場合の留意事項
・店舗販売業(特例を含む)で、インターネット掲示のみの場合、掲示事項(取締規則第106条)の全てを店舗内に掲示しなければならない。
・許可番号、許可証発行日に限って、マスキングして掲示しても良い。
・インターネット掲示と店舗・営業所内掲示を併用しても良い。
◆ 臨床研究において使用される未承認動物用医薬品等の提供等に係る医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律の適用について (令和5年4月20日 5消安第440号 農林水産省消費・安全局長)
○臨床研究に使用される末承認医薬品等の提供等について、法の適用を受けない場合を明文化。
○末承認動物用医薬品等の有効性又は安全性を明らかにする臨床研究等、倫理審査委員会等による研究計画の確認を受けていること、獣医師が主体的に実施する臨床研究であること、提供の対象が営利目的とみなされない範囲内にとどまること、被験者に費用負担が生じる場合は獣医師の営利目的とみなされない範囲内にとどまること、研究目的に即して提供数量が必要な範囲内にとどまること、食用として出荷されないための必要な措置を講じること、治療等の目的で使用されることの防止措這を講じること
●令和4年(2022年)の主な改正
◆「医薬品等の緊急承認制度」の創設 → 厚生労働省HP 、 令和4年の医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)等の一部改正について
・社会的に影響の大きい感染症等が流行等の緊急的に、ワクチンや治療薬を早期に承認する制度。
・動物用において現状では適用するような状況にはないが、動物用にも適用可能となっている。
◆「医薬品等の包装等へのバーコード等の表示の義務付け」法第68条の2の5関係
・人用:令和4年12月1日施行
・動物用:令和6年12月1日施行 → 令和6年の主な改正参照
●令和3年(2021年)以前の主な改正
◆ 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律等の施行について(令和3年8月31日 農林水産省消費・安全局畜水産安全管理課課長補佐)
○添付文書の電子的な方法による提供の原則化
○総括製造販売責任者の基準の見直し(薬剤師をおくことが著しく困難な場合)
○医薬品及び医薬部外品の保管のみを行う製造所の登録制度
○医薬品等の製造管理又は品質管理の方法に関する調査の見直し
○医薬品及び再生医療等製品の変更計画の確認及び計画に従った変更に係る事前届出制の創設等
○許可等業者に対する法令遵守体制の整備
○被検定品の封の廃止 など
(参考)
・医薬品等販売業に係る主な改正 ⇒ こちら
・薬局開設者及び医薬品の販売業者の法令遵守に関するガイドライン( 薬生発0625第13号 厚生労働省通知)
・医療機器の販売 ・貸与業者及び修理業者の法令遵守に関するガイドライン(薬生発0129第5号 厚生労働省通知)
・薬局における法令遵守体制整備の手引き(日本薬剤師会)
◆ 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律等の施行について(令和2年9月1日 農林水産省消費・安全局畜長)
★行政処分等の事例
◆令和7年3月13日:独占禁止法違反(公正取引委員会)
山形県が発注する豚熱ワクチン及び公益社団法人山形県畜産協会が発注する動物用ワクチンの入札等の参加業者に対し、独占禁止法第3条(不当な取引制限の禁止)の規定に違反する(いわゆる入札談合)として、排除措置命令及び課徴金納付命令を行った。
概要はこちらをご覧ください。 (PDF)
◆令和5年12月22日:業務改善命令(人体薬、厚生労働省他)
○違反の内容
(1)テプレノンカプセル50mg「サワイ」について、承認書に記載のない方法により試験を行っていた。(法第18条第3項に基づく法施行規則第96条違反)(2)業務を適正に確保するために必要な体制の整備等、所要の措置を講じていなかった。(製造する医薬品について不適切な試験行為が行われていたが、これを探知することができなかった。)(法第18条の2第3項第2号及び第3号違反)(3)不適切な試験行為の発端となった逸脱発生当時、製品品質に重大な影響が及ぶ恐れのある事象が発生していたにもかかわらず、所要の措置を講じる指示及び進捗管理を実施していなかった。(法第17条第8項で準用する法第8条第1項違反)
○改善命令の内容
(1)法及び関係法令を遵守するよう対応すること。(2)再び法令違反を起こすことのないような体制を構築すること。
①責任役員及び各責任者の権限や業務を明確にすること。②医薬品製造管理者等が製造部門及び品質部門を適切に監督するとともに、製造部門及び品質部門の業務が適切かつ円滑に行われる体制を整備すること。③全ての役職員に継続的に必要な教育訓練を行い、関連法令を遵守させること。 等
○今後の県の対応
(1)沢井製薬(株)九州工場に対して、改善命令発出から1カ月以内を目途に改善計画書を提出するよう指示しており、当該計画書を確認後、立入調査を行い、改善状況を確認する。(2)県内の医薬品等製造業者及び製造販売業者に、今回の事例を踏まえ、自己点検を行う等、改めて法令遵守体制の整備や品質管理体制の向上に取り組むよう周知する。(3)無通告査察の頻度を増やす等、各製造所に対する監視を強化する。
◎医薬品医療機器等法第73条の規定に基づく第一種医薬品製造販売業及び第二種医薬品製造販売業に係る総括製造販売責任者の変更命令(←初事例)
○違反の具体的な内容
同社の総括製造販売責任者について、次のとおり、医薬品医療機器等法に違反する行為があり、管理者として不適当であると認められること。
(1) 同社が製造販売するテプレノンカプセル50mg「サワイ」を製造する製造業者である同社九州工場では、安定性モニタリングの溶出性試験において、カプセルから内容物である顆粒を取り出して別の新しいカプセルに詰め替える作業を行った上で、当該詰め替え後の検体を用いて溶出性試験を実施し合否判定を行うという不適切な方法により試験を行っていた(以下「本件不正行為」という。)。同社の総括製造販売責任者は、本件不正行為が継続的に行われていたにもかかわらずこれを検知できる体制を構築せず、品質管理業務を適正に行わなかった(医薬品医療機器等法第17条第4項の規定に基づく医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則(昭和36年厚生省令第1号)第87条第2項第1号違反)。(2) 同社の総括製造販売責任者は、本件不正行為について報告を受けた後、同社九州工場に対して本件不正行為の事実関係の調査及び原因究明を指示せず、医薬品医療機器等法第12条の2第1項第1号の規定に基づく医薬品、医薬部外品、化粧品及び再生医療等製品の品質管理の基準に関する省令(平成16年厚生労働省令第136号)第3条第2号に定める業務を行わなかった。(3) 同社の総括製造販売責任者は、本件不正行為について報告を受けた後、本件不正行為の全容が明らかになっていない時点では当局への報告を行わない旨判断した上で、大阪府から指摘を受けるまでの間、製造販売業許可権者である大阪府又は厚生労働省に対して、本件不正行為について報告しなかった。(4) 同社の総括製造販売責任者は、同社生産本部が同社九州工場に対して指示した本件不正行為の事実関係についての調査に関し、同社生産本部と密接な連携を行わず、その調査状況の確認を積極的に行わなかった。
◆令和5年12月22日:次の期間業務停止 (→関係法令概要)
(1)第一種動物用医薬品製造販売業の製造販売業務 36日間
(2)動物用医薬品製造業の製造業務 30日間
<処分理由>
(1)について
・ 動物用医薬品の製造・品質試験方法の変更に当たり、承認事項の変更に係る承認取得及び届出等の必要な手続きを行っていなかったこと。
・ 承認内容を反映した製品標準書等に基づいて、製造管理及び品質管理を適切に行っていなかったこと。
・製造業者における動物用医薬品の品質管理が適正に行われるよう監督し、その改善に必要な措置を適切に行っていなかったこと。
・総括製造販売責任者は、品質管理の基準の適合等のために、法令に基づき公正かつ適正に業務を行うべき事項について、遵守していなかったこと。
・ 製造販売業者は、製造管理及び品質管理の基準の適合等のために、法令に基づき公正かつ適正に業務を行うべき事項について、遵守していなかったこと。
(2)について
・承認内容を反映した製品標準書等に基づいて、製造管理及び品質管理を適切に行っていなかったこと。
・製造管理者は、製造管理及び品質管理の基準の適合等のために、法令に基づき公正かつ適正に業務を行うべき事項について、遵守していなかったこと。
・製造業者は、製造所における製造管理及び品質管理の基準の適合等のために、法令に基づき公正かつ適正に業務を行うべき事項について、遵守していなかったこと。
◆平成28年1月8日:第一種医薬品製造販売業及び医薬品製造業の業務停止(医薬品医療機器法第75 条第1項)平成28年1月18日(月)から同年5月6日(金)までの110日間(安全対策業務、製造設備の維持管理に係る業務、製造工程の改善に係る業務並びに「業務停止命令除外品目」に記載する品目に係る製造及び出荷業務を除く。)
(1)承認書の製造方法と整合させた虚偽の製造指図書及び製造記録等を作成し、厚生労働省等の査察に対して、組織的欺罔及び隠蔽を図ってきたこと。
(法第14条第2項第4号、令第3条第1,2項、第7条第1,2,3、第10条第1,2,3,5、法第18条第1,2項、施行規則第92,96条違反)
(2)厚生労働省が昨年9月1日に行ったワクチン等に関する報告命令に対して、適切な報告を行わなかったこと。及び独立行政法人医薬品医療機器総合機構による立入調査において、虚偽の製造記録等を提出する等、適切な対応を行わなかったこと。
(法第69条第4項及び第69条の2第1項違反)
◆平成27年6月12日:第一種医薬品製造販売業の業務について、医薬品の製造管理及び品質管理の方法の改善並びに20日間の業務(製造販売後安全管理に係る業務を除く。)停止。医薬品製造業の業務について、20日間の業務停止。
(1)ワクチン承認申請に係る試験データの一部改ざん。試験成績の信頼性を確保するための試験施設等の運営管理が適正に行われておらず、承認申請書の作成業務を管理する体制が脆弱な状態にあった(旧薬事法第14条第3項及び取締規則第26条第3項及び第29条第1項第1号違反)。 (2)製造業の業務に関して、品質管理基準書(GMP省令)に則さず、品質管理に係る業務を適切に行っていなかった(旧薬事法第18条第2項並びに取締規則第72条及びGMP省令第9条第1号ロ違反)。
◆平成27年1月23日:第一種医薬品製造販売業の業務について、10日間の業務(製造販売後安全管理に係る業務を除く)停止。
ワクチン承認申請に係る試験データの改ざん。(取締規則第29条第1項第1号違反)。また、試験施設等の運営管理が適正に行われておらず、承認申請資料の作成業務を管理する体制が脆弱だった。(旧薬事法第14条第3項及び取締規則第26条第3項違反)

